攀登一条新道路使化学家能够应对癌症最严峻的研究挑战
癌症基因MYC被称为癌症研究的“珠穆朗玛峰”,因为设计可以使它失效的药物的困难,并且期望有效的MYC药物可以帮助如此多的癌症患者。佛罗里达州和德国的RNA科学家,化学家和癌症生物学家之间的合作已经攀登了这一高峰,同时开辟了克服其他类似难以治疗的疾病的新途径。
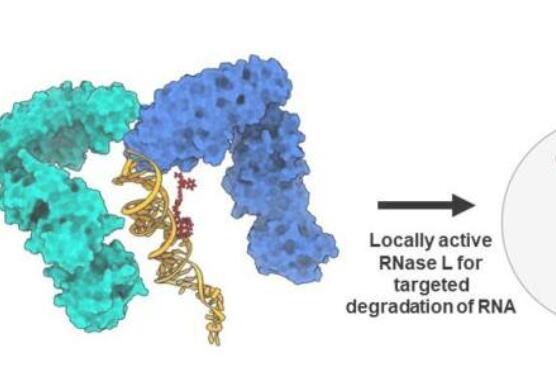
研究人员于24月<>日在《自然》杂志上描述了他们的策略。
科学家们的方法将细胞的回收酶引导到癌症基因的RNA上,并切割关键片段以防止它们造成伤害。该策略对MYC癌症基因以及另外两个具有挑战性的癌症基因JUN和MIR155起作用。所有三个癌症基因都调节其他基因的转录,点燃肿瘤的快速生长。
“对于疾病由这些常见但具有挑战性的癌基因驱动的癌症患者,RNA降解剂方法可能会提供新的希望,”德国多特蒙德马克斯普朗克分子生理学研究所所长Herbert Waldmann博士说。
他们的研究还为用药物靶向RNA开辟了新的可能性,为这种治疗方法开辟了潜在的许多其他遗传疾病,赫伯特韦特海姆UF斯克里普斯生物医学创新与技术研究所和UF健康癌症中心的化学家和研究所教授Matthew D. Disney博士说。
“我们发现了大约2个能够结合类似药物的小分子的新RNA结构,并确定了六种能够结合RNA的新化学型,”迪斯尼说。“我们基本上已经创建了一个可药物RNA折叠的百科全书。
在最具挑战性的药物靶点中,MYC也是最重要的靶点之一。它的激活可能影响70%或更多的人类癌症。它可以指导许多其他基因被构建或沉默。它会影响细胞生长,甚至是导致受损细胞自我毁灭的细胞自杀程序,这是一个称为细胞凋亡的重要过程。它还会影响受损DNA的修复过程和血管的生长。在许多癌症中,MYC过度表达,导致细胞生长和分裂过快。
另一种癌症基因JUN的激活已在20多种不同的癌症类型中发现,包括胶质母细胞瘤,乳腺癌,前列腺癌,肺癌,结直肠癌等。
与此同时,一种名为MIR155的小RNA基因驱动炎症以及许多癌症的生长和扩散。研究人员发现它在乳腺癌、肾癌、胃癌和其他癌症中被激活。
制造防止三种癌基因造成伤害的药物的努力在很大程度上失败了,因为它们面临着复杂的结构挑战。
国际合作
克服这些挑战需要由三个实验室组成的国际团队的努力。
在佛罗里达州,迪士尼的小组带来了有关RNA结构药物发现和新RNA降解技术的见解。
在马克斯普朗克分子生理学研究所,Waldmann的小组设计了受天然物质启发的化合物,例如那些启发了许多抗生素和抗癌药物的化合物。
德国明斯特大学有机化学研究所的有机化学家Frank Glorius博士开发了构建新型药物样分子的创新方法。他的一些化合物存放在Waldmann的收藏中,专门设计用于影响细胞膜的生物学。源自咪唑的化合物,一种在天然产物和药物中常见的分子,用碳基链修饰,最终被证明是与癌症连锁RNA结合的最有效方法。
“这些化合物看起来有点像两条细长的腿上的电视,”格洛里乌斯说。
“这是一次真正的合作,”Waldmann补充道。“我们三个人和我们的团队都需要得出这些见解。
建立合作伙伴关系的想法最早出现在2016年西班牙的一次科学会议上,当时Waldmann和迪士尼在一次谈话后比较了笔记。两人都同意,用药物靶向RNA提供了一种令人兴奋的靶向不治之症的可能方法,但目前还为时尚早。市场上没有这样的东西。
靶向RNA以阻止癌症
RNA是一个困难的药物靶向挑战。RNA仅由四个核苷酸组成,有很多工作。它读取基因,组装蛋白质并被回收以在细胞中进行其他工作。它的结构是如此多样和多变,以至于制药行业的许多人都认为试图制造RNA导向的药物是一种毫无意义的练习。
但在15年的时间里,迪斯尼和他的团队已经发现了许多保守的、可成药的RNA结构。迪士尼的团队建立了自己的化合物集合,并在小鼠中表明,靶向RNA可以消灭癌症肿瘤并改善其他疾病,包括ALS和强直性肌营养不良症。RNA为解决药物无法达到的关键蛋白质结构的疾病提供了一种替代途径。
在最初的谈话之后,迪士尼在2018年派遣了他的实验室的两名成员,当时的研究生Matthew Costales博士和Hafeez Hanif博士前往多特蒙德,使用他们的筛选方法来寻找潜在的RNA结合候选者。迪士尼表示,结果超出了他的预期。总的来说,他们探测了化合物集合与人类RNA之间的61多万个相互作用。当他们查看他们的结果时,他们发现已知的,可药物的RNA结构的宇宙已经急剧扩大。
但是,还需要几年的工作才能将他们发现的这些结构和化合物与困难的癌症靶点MYC,c-JUN和MIR155联系起来。
来自Wertheim UF Scripps研究所迪斯尼实验室的高级科学家Jessica Childs-Disney博士和研究生Yuquan Tong进行了许多这些关键实验。
“我们发现仅仅结合这些靶标的RNA是不够的。仅凭这一点并没有产生足够的影响。我们还必须修改化合物,以便它们可以招募靶向小分子RNA降解酶,“Tong说。
迪士尼设计了一种创新方法来编辑这些致病RNA片段。他通过在分子上安装一个化学鱼钩来做到这一点,该鱼钩旨在捕获细胞的RNA回收酶。它按计划工作。RNA回收酶切碎了药物分子附着的RNA,阻止了致病蛋白质的构建。他们称他们的杂交分子为RiboTAC,是“靶向嵌合体的核糖核酸酶”的缩写。
“随着降解剂的加入,我们开始看到这些'不可成药'的癌症RNA减少了35%,40%,50%或更多。这导致癌细胞死亡并在基于小鼠的乳腺癌研究中清除肿瘤,这些肿瘤扩散到肺部,“迪斯尼说。
迪士尼联系了一位前同事,MYC在癌症中的作用的领先专家John Cleveland博士,克利夫兰是坦帕莫菲特癌症中心的执行副总裁,中心主任和首席科学官。
“我们的实验室测试了旨在破坏MYC RNA的RiboTAC化合物的功效,并表明它们有效地杀死了由MYC驱动的B细胞淋巴瘤,这是非常具有侵略性和难以治疗的肿瘤,”克利夫兰说。“总而言之,这些结果 - 人们现在可以设计特定的RNA降解剂来禁用许多致癌RNA - 代表了抗癌治疗的真正变革性步骤。
Waldmann说,该研究表明,受天然产物启发的化合物类别为靶向RNA疾病靶标提供了丰富的新来源。
“当然,我们正在进一步开发它们,遵循我们的伪天然产物概念,从而扩大这种独特化学物质定义的化学空间的覆盖范围,”Waldmann说。
他补充说,由于该策略非常新颖,因此在创新通过临床试验到达患者之前,还需要几年的额外工作。
“这是一条漫长的道路,实际上是一场马拉松比赛,”沃尔德曼说。
迪士尼说,这些化合物正在向科学家们展示在哪里制造更多更好的药物来对抗这些曾经不可能的癌症靶点,并提供一系列新的RNA结构,以便在其他疾病环境中进行测试。他在Wertheim UF Scripps研究所的团队特别关注癌症和其他难以治疗的疾病。
“这是一个起点。它向我们展示了在哪里建立小分子,RNA靶向药物,最终可以治疗患有侵袭性癌症等疾病的患者,这些疾病目前选择不佳或没有选择,“迪士尼说。“这些新数据还向我们表明,这种方法可能还有许多其他疾病应用。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
安徽淮南地区的长安汽车经销商近期对2025款启源Q05车型的市场策略进行了调整,以进一步吸引消费者。作为长安汽...浏览全文>>
-
近年来,豪华SUV市场持续升温,而作为大众旗下的高端品牌,途锐凭借其卓越的性能与豪华配置,一直深受消费者的...浏览全文>>
-
在新能源汽车市场中,一汽-大众ID 4 CROZZ凭借其出色的性价比和丰富的配置吸引了众多消费者的关注。作为一款...浏览全文>>
-
近年来,随着国内汽车市场的快速发展,越来越多的消费者开始关注性价比高的小型车。QQ多米作为一款备受关注的...浏览全文>>
-
在当今的汽车市场中,选择一款高性价比的车型是许多消费者的重要考量。对于追求品质与经济平衡的购车者来说,...浏览全文>>
-
阜阳地区消费者对上汽大众途岳的关注度一直很高,尤其是2025款途岳的上市更是引发了广泛关注。作为一款紧凑型S...浏览全文>>
-
天津滨海长安猎手K50作为一款备受关注的车型,在市场上拥有较高的关注度。这款车型以其出色的性能和合理的价格...浏览全文>>
-
近年来,随着新能源汽车的普及,插电混动车型因其兼顾燃油经济性和驾驶性能的特点,受到了越来越多消费者的青...浏览全文>>
-
途观X作为上汽大众旗下的高端轿跑SUV车型,凭借其时尚动感的外观设计和丰富的科技配置,在市场上一直备受关注...浏览全文>>
-
在选择SUV车型时,上汽大众途昂凭借其宽敞的空间和强大的性能成为不少消费者的首选。对于蚌埠地区的消费者来说...浏览全文>>
- 天津滨海长安猎手K50多少钱 2025款落地价,最低售价18.29万起,赶紧行动
- 天津滨海ID.4 CROZZ 2025新款价格,买车省钱秘籍
- 安徽淮南途昂X多少钱?性价比超高的选车秘籍
- 福特领睿试驾,开启完美驾驭之旅
- 比亚迪海豹05DM-i试驾预约流程
- 凯迪拉克CT5预约试驾,从预约到试驾的完美旅程
- 滁州途观X落地价,各配置车型售价全知晓
- 极狐 阿尔法T6试驾,开启完美驾驭之旅
- 长安欧尚520试驾操作指南
- QQ多米试驾需要注意什么
- 长安Lumin试驾,感受豪华与科技的完美融合
- 安庆长安猎手K50最新价格2025款与配置的完美平衡
- 池州迈腾GTE最新价格2022款全解,买车必看的省钱秘籍
- 安徽亳州ID.6 X多少钱?购车全攻略来袭
- 五菱雪宝试驾,开启豪华驾驶之旅
- 马自达EZ-6预约试驾,新手必看的详细流程
- 安徽亳州T-ROC探歌落地价实惠,配置丰富,不容错过
- 滁州高尔夫GTI价格大揭秘,买车前必看
- 东莞威然落地价,最低售价22.99万起优惠不等人
- 试驾王牌M7,体验豪华驾乘的乐趣
